Kuidas koostada keemiliste elementide elektroonilisi valemeid. Aatomi elektrooniline konfiguratsioon
Algoritm elemendi elektroonilise valemi koostamiseks:
1. Määrake elektronide arv aatomis, kasutades keemiliste elementide perioodilist tabelit D.I. Mendelejev.
2. Määrake selle perioodi numbri järgi, milles element asub, energiatasemete arv; elektronide arv viimasel elektroonilisel tasemel vastab rühmanumbrile.
3. Jagage nivood alamtasanditeks ja orbitaalideks ning täitke need elektronidega vastavalt orbitaalide täitmise reeglitele:
Tuleb meeles pidada, et esimesel tasemel on maksimaalselt 2 elektroni. 1s2, teisel - maksimaalselt 8 (kaks s ja kuus R: 2s 2 2p 6), kolmandal - maksimaalselt 18 (kaks s, kuus lk ja kümme d: 3s 2 3p 6 3p 10).
- Peamine kvantarv n peaks olema minimaalne.
- Esmalt täidetud s- alamtasand siis p-, d-b f- alamtasandid.
- Elektronid täidavad orbitaale orbiidi energia kasvavas järjekorras (Kletškovski reegel).
- Alamtasandi sees hõivavad elektronid esmalt ükshaaval vabad orbitaalid ja alles pärast seda moodustavad paarid (Hundi reegel).
- Ühel orbitaalil ei saa olla rohkem kui kaks elektroni (Pauli põhimõte).
Näited.
1. Koostage lämmastiku elektrooniline valem. Lämmastik on perioodilisuse tabeli number 7.

2. Koostage argooni elektrooniline valem. Perioodilises tabelis on argoon number 18.
1 s 2 2 2 2 p 6 3 s 2 3 p 6.

3. Koostage kroomi elektrooniline valem. Perioodilises tabelis on kroom number 24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5

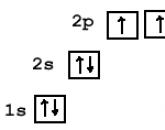
Tsingi energiadiagramm.
4. Koostage tsingi elektrooniline valem. Perioodilises tabelis on tsink number 30.
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 p 10
Pange tähele, et osa elektroonilisest valemist, nimelt 1s 2 2s 2 2p 6 3s 2 3p 6, on argooni elektrooniline valem.
Tsingi elektroonilist valemit saab esitada järgmiselt.
Selleks, et õppida koostama elektrongraafilisi valemeid, on oluline realiseerida tuuma tuuma struktuuri teooria. Aatomi tuum koosneb prootonitest ja neutronitest. Elektronid paiknevad aatomituuma ümber olevatel elektronorbitaalidel.
Sa vajad
- - pliiats;
- - märkmepaber;
- - elementide perioodiline süsteem (Mendelejevi tabel).
Juhend
1. Aatomi elektronid hõivavad vabad orbitaalid järjestuses, mida nimetatakse energiaskaalaks: 1s/2s, 2p/3s, 3p/4s, 3d, 4p/5s, 4d, 5p/6s, 4d, 5d, 6p/7s, 5f, 6d , 7p . Kaks elektroni, millel on vastupidised spinnid – pöörlemissuunad võivad asuda ühel orbitaalil.
2. Elektronkestade disain väljendub graafiliste elektrooniliste valemite toel. Kasutage valemi kirjutamiseks maatriksit. Üks rakk võib sisaldada ühte või kahte vastupidiste spinnidega elektroni. Elektronid on kujutatud nooltega. Maatriks näitab selgelt, et s-orbitaalil võivad paikneda kaks elektroni, p-orbitaalil 6, d-orbitaalil 10 ja f-orbitaalil 14 elektroni.

3. Mõelge reeglile elektroonilise graafilise valemi koostamiseks, kasutades näitena mangaani. Leia mangaan perioodilisuse tabelist. Selle seerianumber on 25, mis tähendab, et aatomis on 25 elektroni, see on neljanda perioodi element.
4. Kirjutage maatriksi kõrvale elemendi seerianumber ja tähis. Vastavalt energiaskaalale täitke astmed 1s, 2s, 2p, 3s, 3p, 4s samm-sammult, sisestades kaks elektroni raku kohta. Saad 2+2+6+2+6+2=20 elektroni. Need tasemed on täielikult täidetud.

5. Teil on jäänud veel viis elektroni ja tühi 3D-tasand. Paigutage elektronid d-alataseme rakkudes, alustades vasakult. Asetage rakkudesse ühekaupa identsete spinnidega elektronid. Kui kõik rakud on täidetud, lisage vasakult alustades teine elektron vastupidise spinniga. Mangaanis on viis d-elektroni, mis asuvad ükshaaval kogu rakus.

6. Elektrongraafilised valemid näitavad selgelt valentsi määravate paaritute elektronide arvu.
Matemaatika, füüsika, keemia teoreetilisi ja faktilisi töid luues seisab üliõpilane või koolilaps silmitsi vajadusega sisestada spetsiaalseid sümboleid ja keerulisi valemeid. Omades Microsofti kontorikomplektist Wordi rakendust, on lubatud sisestada elektrooniline valem iga raskus.

Juhend
1. Avage uusim dokument Microsoft Wordis. Andke sellele nimi ja salvestage see samasse kausta, kus on teie töö, et te seda edaspidi ei otsiks.
2. Minge vahekaardile "Sisesta". Paremal leiate sümboli ? ja selle kõrval on kiri "Valem". Klõpsake noolt. Ilmub aken, kus saate eelistada sisseehitatud valemit, näiteks ruutvõrrandi valemit.
3. Klõpsake noolel ja ülemisele paneelile ilmuvad erinevad sümbolid, mida võib selle konkreetse valemi kirjutamisel vaja minna. Kui muudate seda soovitud viisil, saate selle salvestada. Nüüdsest langeb see sisseehitatud valemite loendist välja.
4. Kui teil on vaja valem tekstile üle kanda, see, mis tuleb hiljem saidile paigutada, klõpsake hiire parema nupuga energiaväljal ja valige mitte üliprofessionaalne, vaid lineaarne kirjutamisviis. Eelkõige on sama ruutvõrrandi valem sel juhul järgmine: x=(-b±?(b^2-4ac))/2a.
5. Teine võimalus elektroonilise valemi kirjutamiseks Wordis on konstruktori kaudu. Hoidke samal ajal all klahve Alt ja =. Kohe avaneb valemi kirjutamise väli ja ülemisel paneelil avaneb konstruktor. Siin saate eelistada kõiki märke, mida võib vaja minna võrrandi kirjutamiseks ja mis tahes ülesande lahendamiseks.
6. Mõned lineaarsed märgistussümbolid võivad arvutisümboleid tundmatule lugejale ebaselged olla. Sel juhul on mõttekas salvestada kõige keerulisemad valemid või võrrandid graafilisel kujul. Selleks avage lihtsaim graafiline redaktor Paint: "Start" - "Programmid" - "Paint". Pärast seda suumige valemidokumenti nii, et see hõivaks kõik ekraanid. See on vajalik, et salvestatud pildil oleks kõrgeim eraldusvõime. Vajutage klaviatuuril PrtScr, minge Paint ja vajutage Ctrl+V.
7. Lõika ära üleliigne. Selle tulemusena saate vajaliku valemiga kindla pildi.
Seotud videod
Märge!
Pidage meeles, et keemia on erandite teadus. Perioodilise süsteemi sekundaarsete alamrühmade aatomitel on elektronide "läbimurre". Näiteks kroomis, mille aatomnumber on 24, läheb üks 4s-tasandi elektronidest d-astme rakku. Sarnane tulemus on ka molübdeenil, nioobiumil jt. Lisaks on olemas aatomi ergastusseisundi esitus, kui paaris elektronid on paaritumata ja kanduvad üle naaberorbitaalidele. Seetõttu vaadake sekundaarse alarühma viienda ja järgnevate perioodide elementide elektrooniliste graafiliste valemite koostamisel teatmeteost.
Elementide aatomite elektrooniliste valemite kirjutamisel näidatakse energiatasemeid (peamise kvantarvu väärtused n numbrite kujul - 1, 2, 3 jne), energia alamtasemed (orbitaalkvantarvu väärtused l kirjade kujul s, lk, d, f) ja ülaosas olev number näitab elektronide arvu antud alamtasemel.
Esimene element D.I. Mendelejev on vesinik, seega aatomituuma laeng H võrdne 1-ga, on aatomil ainult üks elektron s esimese taseme alamtase. Seetõttu on vesinikuaatomi elektrooniline valem:
Teine element on heelium, selle aatomis on kaks elektroni, seetõttu on heeliumi aatomi elektrooniline valem 2 Mitte 1s 2. Esimene periood sisaldab ainult kahte elementi, kuna esimene energiatase on täidetud elektronidega, mida saab hõivata ainult 2 elektroni.
Järjekorras kolmas element - liitium - on juba teises perioodis, seetõttu hakkab selle teine energiatase täituma elektronidega (sellest rääkisime eespool). Teise taseme täitmine elektronidega algab s-alamtase, seega on liitiumi aatomi elektrooniline valem 3 Li 1s 2 2s 1 . Berülliumi aatomis on elektronidega täitmine lõppenud s- alamtasandid: 4 Ve 1s 2 2s 2 .
2. perioodi järgnevate elementide puhul on teine energiatase jätkuvalt täidetud elektronidega, alles nüüd on see elektronidega täidetud R- alamtase: 5 IN 1s 2 2s 2 2R 1 ; 6 KOOS 1s 2 2s 2 2R 2 … 10 Ne 1s 2 2s 2 2R 6 .
Neoonaatom täidab elektronidega lõpu R-alamtase, see element lõpetab teise perioodi, sellel on kaheksa elektroni, kuna s- Ja R-alamtasemed võivad sisaldada ainult kaheksat elektroni.
3. perioodi elementidel on sarnane jada kolmanda taseme energia alamtasandite elektronidega täitmisel. Mõnede selle perioodi elementide aatomite elektroonilised valemid on järgmised:
11 Na 1s 2 2s 2 2R 6 3s 1 ; 12 mg 1s 2 2s 2 2R 6 3s 2 ; 13 Al 1s 2 2s 2 2R 6 3s 2 3lk 1 ;
14 Si 1s 2 2s 2 2R 6 3s 2 3lk 2 ;…; 18 Ar 1s 2 2s 2 2R 6 3s 2 3lk 6 .
Kolmas periood, nagu ka teine, lõpeb elemendiga (argoon), mis täidab selle elektronidega R-alamtase, kuigi kolmas tase sisaldab kolme alamtasandit ( s, R, d). Vastavalt ülaltoodud energia alamtasandite täitmise järjekorrale vastavalt Klechkovsky reeglitele on alamtaseme 3 energia d rohkem alamtasandi 4 energiat s Seetõttu on argoonile järgnev kaaliumiaatom ja sellele järgnev kaltsiumiaatom täidetud elektronidega 3 s- neljanda taseme alamtase:
19 TO 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 1 ; 20 Sa 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 2 .
Alates 21. elemendist - skandiumist hakkab elementide aatomites alamtase 3 täituma elektronidega d. Nende elementide aatomite elektroonilised valemid on järgmised:
21 sc 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 2 3d 1 ; 22 Ti 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 2 3d 2 .
24. elemendi (kroom) ja 29. elemendi (vask) aatomites täheldatakse nähtust, mida nimetatakse elektroni "läbimurdeks" või "tõrkeks": elektron välisest 4-st. s-alamtase "ebaõnnestub" 3 võrra d– alamtase, mis täidab selle poole võrra (kroom) või täielikult (vase puhul), mis aitab kaasa aatomi suuremale stabiilsusele:
24 Kr 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 1 3d 5 (...4 asemel s 2 3d 4) ja
29 Cu 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 1 3d 10 (...4 asemel s 2 3d 9).
Alates 31. elemendist - galliumist, jätkub 4. taseme täitmine elektronidega, nüüd - R- alamtase:
31 Ga 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 2 3d 10 4lk 1 …; 36 Kr 1s 2 2s 2 2R 6 3s 2 3lk 6 4s 2 3d 10 4lk 6 .
See element lõpetab neljanda perioodi, mis sisaldab juba 18 elementi.
Sarnane energia alamtasandite elektronidega täitmise järjekord toimub ka 5. perioodi elementide aatomites. Esimesed kaks (rubiidium ja strontsium) on täidetud s- 5. taseme alamtase, täidetakse järgmised kümme elementi (ütriumist kaadmiumini) d– 4. taseme alamtase; kuus elementi lõpetavad perioodi (indiumist ksenoonini), mille aatomites on täidetud elektronid R-välimise, viienda tasandi alamtase. Perioodis on ka 18 elementi.
Kuuenda perioodi elementide puhul on seda täitmisjärjekorda rikutud. Perioodi alguses, nagu tavaliselt, on kaks elementi, mille aatomites on täidetud elektronid s-välise, kuuenda, tasandi alamtase. Järgmisel elemendil - lantaanil - hakkab täituma elektronidega d–eelmise taseme alamtase, s.o. 5 d. Sellel elektronidega täitmisel 5 d-alamtase peatub ja järgmised 14 elementi – tseeriumist luteetiumini – hakkavad täituma f- 4. taseme alamtase. Kõik need elemendid sisalduvad tabeli ühes lahtris ja allpool on nende elementide laiendatud seeria, mida nimetatakse lantaniidideks.
Alates 72. elemendist - hafniumist - kuni 80. elemendini - elavhõbe, jätkub elektronidega täitmine 5 d- alamtase ja periood lõpeb, nagu tavaliselt, kuue elemendiga (talliumist radoonini), mille aatomites on see elektronidega täidetud R-välise, kuuenda, tasandi alamtase. See on suurim periood, sealhulgas 32 elementi.
Seitsmenda, mittetäieliku perioodi elementide aatomites on näha samasugune alamtasandite täitmise järjekord, nagu eespool kirjeldatud. Võimaldame õpilastel kirjutada 5. - 7. perioodi elementide aatomite elektroonilisi valemeid, võttes arvesse kõike eespool öeldut.
Märge:osades õpikutes on lubatud elementide aatomite elektrooniliste valemite kirjutamise erinev järjekord: mitte nende täitmise järjekorras, vaid vastavalt tabelis toodud elektronide arvule igal energiatasemel. Näiteks võib arseeni aatomi elektrooniline valem välja näha järgmine: As 1s 2 2s 2 2R 6 3s 2 3lk 6 3d 10 4s 2 4lk 3 .
Aatom on elektriliselt neutraalne süsteem, mis koosneb positiivselt laetud tuumast ja negatiivselt laetud elektronidest. Elektronid paiknevad aatomis, moodustades energiatasemed ja alamtasandid.
Aatomi elektrooniline valem on elektronide jaotus aatomis energiatasemete ja alamtasandite vahel vastavalt vähima energia printsiibile (Klechkovsky), Pauli printsiibile, Hundi reeglile.
Elektroni olekut aatomis kirjeldatakse kvantmehaanilise mudeli abil – elektronpilve, mille vastavate lõikude tihedus on võrdeline elektroni leidmise tõenäosusega. Tavaliselt mõistetakse elektronipilve all tuumaruumi piirkonda, mis katab ligikaudu 90% elektronpilvest. Seda ruumipiirkonda nimetatakse ka orbitaaliks.
Aatomiorbitaalid moodustavad energia alamtasandi. Orbitaalidele ja alamtasanditele on määratud tähetähised. Igal alamtasandil on teatud arv aatomiorbitaale. Kui aatomiorbitaali kujutatakse magnet-kvantrakuna, saab alamtasanditel paiknevaid aatomiorbitaale kujutada järgmiselt:
Iga aatomiorbitaal ei tohi sisaldada korraga rohkem kui kahte elektroni, mis erinevad spinni poolest (Pauli põhimõte). Seda erinevust tähistavad nooled ¯. Teades seda s- alatase esimene s-orbitaal, sees R-kolmas alamtase R-orbitaalid, sisse d- alamtase viis d-orbitaalid, sisse f- alamtase seitse f- orbitaalid, leiate igal alamtasemel ja tasemel maksimaalse elektronide arvu. Jah, edasi s-alamtase, alates esimesest energiatasemest, 2 elektroni; peal R-alamtase, alates teisest energiatasemest, 6 elektroni; peal d-alamtase, alates kolmandast energiatasemest, 10 elektroni; peal f-alamtase, alates neljandast energiatasemest, 14 elektroni. Elektronid sisse s-, p-, d-, f- alamtasandid on vastavalt nimetatud s-, p-, d-, f-elektronid.
Vastavalt vähima energia põhimõte, toimub energia alamtasandite järjestikune täitumine elektronidega nii, et iga elektron aatomis hõivab madalaima energiaga alamtaseme, mis vastab tema tugevale sidemele tuumaga. Alamtasandite energia muutust võib esitada Klechkovsky seeria või energiaskaalana:
1s<2s<2lk<3s<3lk<4s<3d<4lk<5s<4d<5lk<6s<4f<5d<6lk<7s<5f<6d<7lk...
Hundi reegli kohaselt täidetakse energia alamtasandi iga kvantrakk (orbitaal) esmalt üksikute sama spinniga elektronidega ja seejärel teise vastupidise spinniga elektroniga. Kaht elektroni, mille spinnid on vastassuunalised samal aatomiorbitaalil, nimetatakse paaritud elektronideks. Üksikud elektronid on paaritumata.
Näide 1 Asetage peale 7 elektroni d-alamtase, arvestades Hundi reeglit.
Lahendus.
Peal d alamtasand – viis aatomiorbitaali. Samal alamtasandil olevate orbitaalide energia on sama. Siis d alamtasandit saab esitada järgmiselt: d ![]() . Pärast aatomiorbitaalide täitmist elektronidega, võttes arvesse Hundi reeglit d- alamtase näeb välja selline
. Pärast aatomiorbitaalide täitmist elektronidega, võttes arvesse Hundi reeglit d- alamtase näeb välja selline ![]() .
.
Kasutades nüüd vähima energia ja Pauli põhimõtteid, jaotame elektronid aatomites energiatasemete järgi (tabel 1).
Tabel 1
Elektronide jaotus aatomite energiatasemete vahel
Selle skeemi abil on võimalik selgitada perioodilise süsteemi elementide aatomite elektrooniliste struktuuride moodustumist, mis on kirjutatud elektrooniliste valemite kujul. Elektronide koguarvu aatomis määrab elemendi aatomnumber.
Niisiis, esimese perioodi elementide aatomites üks s-esimese energiataseme orbitaal (tabel 1). Kuna sellel tasemel on kaks elektroni, siis esimesel perioodil on ainult kaks elementi (1 H ja 2 He), mille elektroonilised valemid on järgmised: 1 H 1 s 1 ja 2 mitte 1 s 2 .
Teise perioodi elementide aatomites on esimene energiatase täielikult elektronidega täidetud. täidetakse järjest elektronidega s- Ja R-teise energiataseme alamtasandid. Summa s- Ja R-elektrone, mis selle taseme täitsid, on kaheksa, seega on teises perioodis 8 elementi (3 Li ... 10 ne).
Kolmanda perioodi elementide aatomites on esimene ja teine energiatase täielikult elektronidega täidetud. täidetakse järjest s- Ja R-kolmanda energiataseme alamtasandid. Summa s- Ja R-elektronid, mis täitsid kolmanda energiataseme, on kaheksa. Seetõttu on kolmandal perioodil 8 elementi (11 Na ... 18 Ar).
Neljanda perioodi elementide aatomites on esimene, teine ja kolmas täidetud 3 s 2 3R 6 energiataset. Kolmandal energiatasandil jääb vaba alles d- alamtase (3 d). Selle alamtaseme täitmine elektronidega ühest kuni kümneni algab pärast seda, kui see on täidetud maksimaalsete elektronidega 4 s- alamtase. Lisaks toimub elektronide paigutus 4 R- alamtase. Summa 4 s-, 3d- ja 4p-elektronid võrdub kaheksateistkümnega, mis vastab 18 neljanda perioodi elemendile (19 K ... 36 Kr).
Samamoodi toimub viienda perioodi elementide aatomite elektrooniliste struktuuride moodustumine selle ainsa erinevusega s- Ja R- alamtasandid on viiendal ja d- alamtasand neljandal energiatasandil. Kuna summa on 5 s-, 4d- ja 5 R-elektronid on kaheksateist, siis viiendal perioodil on 18 elementi (37 Rb ... 54 Xe).
Ülisuures kuuendas perioodis on 32 elementi (55 Cs ... 86 Rn). See arv vastab elektronide summale 6 võrra s-, 4f-, 5d- ja 6 R- alamtasandid. Alamtasandite elektronidega täitmise järjekord on järgmine. Esmalt täidetud elektronidega 6 s- alamtase. Siis, vastupidiselt Klechkovsky seeriale, täidetakse see ühe elektroniga 5 d- alamtase. Pärast seda täidetakse 4 maksimaalselt. f- alamtase. Järgmisena täidetakse 5 d- ja 6 R- alamtasandid. Eelmised energiatasemed on täidetud elektronidega.
Sarnast nähtust täheldatakse seitsmenda perioodi elementide aatomite elektrooniliste struktuuride moodustamisel.
Seega, elemendi aatomi elektroonilise valemi kirjutamiseks peate teadma järgmist.
1. Elemendi järjekorranumber elementide perioodilises süsteemis D.I. Mendelejev, mis vastab elektronide koguarvule aatomis.
2. Perioodi arv, mis määrab aatomi energiatasemete koguarvu. Sel juhul vastab aatomi viimase energiataseme number perioodi numbrile, milles element paikneb. Teise ja kolmanda perioodi elementide aatomites toimub viimase energiataseme täitmine elektronidega järgmises järjestuses: ns 1–2 …nr 1–6. Kolmanda ja neljanda perioodi elementide aatomites täidetakse viimase ja eelviimase energiataseme alamtasemed elektronidega järgmiselt: ns 1–2 …(n–1)d 1–10 …nr 1–6. Kuuenda ja seitsmenda perioodi elementide aatomites on alamtasandite elektronidega täitmise järjekord järgmine: ns 1–2 …(n–1)d 1 …(n-2)f 1–14 …(n–1)d 2–10 …nr 1–6 .
3. Põhialarühmade elementide aatomites summa s- Ja R-elektronid viimasel energiatasemel on võrdne rühma numbriga.
4. Sekundaarsete alamrühmade elementide aatomites summa d-elektronid eelviimasel ja s-elektronid viimastel energiatasemetel on võrdne rühmaarvuga, välja arvatud koobalti, nikli, vase ja tsingi alamrühmade elementide aatomid.
Elektronide paiknemine sama energia alamtasandi aatomiorbitaalidel toimub vastavalt Gundi reegel: samal alamtasandil paiknevate elektronide spinni koguväärtus peaks olema maksimaalne, s.o. antud alamtase orbitaali kohta võtab esmalt vastu ühe paralleelsete spinnidega elektroni ja seejärel teise vastupidise spinniga elektroni.
Näide 2 . Kirjutage elementide aatomite elektroonilised valemid, mille seerianumbrid on 4, 13, 22.
Lahendus. Aatomnumbriga 4 element on berüllium. Seetõttu on berülliumi aatomis 4 elektroni. Berüllium on teises perioodis, põhialagrupi teises rühmas. Perioodi number vastab energiatasemete arvule, st. kaks. Need energiatasemed peavad mahutama nelja elektroni. Esimesel energiatasemel on kaks elektroni (1 s 2) ja teisel on samuti kaks elektroni (2 s 2) (vt tabel 1). Seega on elektroonilisel valemil järgmine vorm: 4 Ole 1 s 2 2s 2. Viimase energiataseme elektronide arv vastab selle rühma arvule, milles see asub.
Element alumiinium vastab perioodilises süsteemis elemendile 13. Alumiinium on kolmandas perioodis, kolmandas rühmas, põhialagrupis. Seetõttu peab kolmandal energiatasemel olema kolm elektroni, mis paigutatakse järgmiselt: 3 s 2 3R 1 (summa s- Ja R-elektronid on võrdne rühmaarvuga). Kümme elektroni on esimesel ja teisel energiatasemel: 1 s 2 2s 2 2lk 6 (vt tabel 1). Üldiselt on alumiiniumi elektrooniline valem järgmine: 13 Al 1 s 2 2s 2 2lk 6 3s 2 3lk 1 .
Perioodilises süsteemis on elemendiks aatomnumbriga 22 titaan. Titaani aatomis on kakskümmend kaks elektroni. Need on paigutatud neljale energiatasemele, kuna element on neljandas perioodis. Elektronide paigutamisel alamtasanditesse tuleb arvestada, et tegemist on kõrvalalarühma neljanda rühma elemendiga. Seetõttu neljandal energiatasandil s-alamtasandil on kaks elektroni: 4 s 2. Esimene, teine, kolmas tase s- Ja R- alamtasandid on täielikult täidetud elektronidega 1 s 2 2s 2 2lk 6 3s 2 3lk 6 (vt tabel 1). Ülejäänud kaks elektroni asuvad peal d- kolmanda energiataseme alamtase: 3 d 2. Üldiselt on titaani elektrooniline valem: 22 Ti 1 s 2 2s 2 2lk 6 3s 2 3lk 6 3d 2 4s 2 .
Elektronide "libisemine".
Elektrooniliste valemite kirjutamisel tuleks arvestada elektronide "lekkimisega". s- välise energiataseme alamtase ns peal d- välise-eelse tasandi alamtase ( n – 1)d. Eeldatakse, et selline seisund on energeetiliselt kõige soodsam. Mõne aatomis toimub elektroni "libisemine". d-elemendid, näiteks 24 Cr, 29 Cu, 42 Mo, 47 Ag, 79 Au, 41 Nb, 44 Ru, 45 Rh, 46 Pd.
Näide 3. Kirjutage kroomi aatomi elektrooniline valem, võttes arvesse ühe elektroni "läbimurret".
Lahendus. Kroomi elektrooniline valem peaks minimaalse energia põhimõtte kohaselt olema: 24 Cr 1 s 2 2s 2 2lk 6 3s 2 3lk 6 3d 4 4s 2. Selle elemendi aatomis on aga ühe "libisemine". s-elektron väliselt 4 s- alamtasemest alamtasemeni 3 d. Seetõttu on elektronide paigutus kroomi aatomis: 24 Cr 1 s 2 2s 2 2lk 6 3s 2 3lk 6 3d 5 4s 1 .
Praktiline töö
1. Põhisätted
Keemiliste elementide perioodiline süsteem ja aatomi ehitus
Perioodilise seaduse kaasaegne määratlus
Keemiliste elementide ja nendest moodustuvate ainete omadused on perioodilises sõltuvuses nende aatomituumade laengutest
Keemiliste elementide perioodilise süsteemi tabel on perioodilise seaduse graafiline esitus.
Iga number selles iseloomustab mõnda aatomite seisu tunnust:
A)järguline Keemilise elemendi (aatom)arv näitab selle aatomituuma laengut ehk selles sisalduvate prootonite arvu ja kuna aatom on elektriliselt neutraalne, siis elektronide arvu aatomituuma ümber.
Neutronite arv määratakse valemiga:N = A - Z ,
KusA - massiarv (aatommass),Z - elemendi seerianumber;
b) perioodi arv vastab energiatasemete (elektrooniliste kihtide) arvule antud perioodi elementide aatomites;
c) rühmaarv vastab põhialarühmade elementide elektronide arvule välistasandil ja sekundaarsete alarühmade elementide puhul maksimaalsele valentselektronide arvule.
Elementide metalliliste ja mittemetalliliste omaduste muutmine
perioodidel ja rühmades
1. Ühe perioodi jooksul seerianumbri suurenemisega elementide metallilised omadused nõrgenevad ja mittemetallilised omadused suurenevad, kuna:
1) arv ē kasvab aatomite välistasandil (see võrdub rühma arvuga);
2) energiatasemete arv perioodi sees ei muutu (see võrdub perioodi arvuga);
3) aatomite raadius väheneb.
2. Samas rühmas (peamine alarühm) seerianumbri suurenemisega elementide metallilised omadused suurenevad ja mittemetallilised nõrgenevad, kuna:
1) elektronide arv aatomite välistasandil on sama (see võrdub rühmaarvuga);
2) energiatasemete arv aatomites kasvab (see võrdub perioodi arvuga);
3) aatomite raadius suureneb.
Tõendid aatomi ehituse keerukusest
1. Iiri füüsik Stoney võttis osakeste tähistamiseks kasutusele mõiste "elektron" (näiteks eboniidipulga elektriseerimine), staatilise elektri ilmumist riietele.
2. Katoodkiired – elektronide voog metalli aatomitest, millest katood on valmistatud, pani klaasi hõõguma (Thomson ja Perrin). Elektroni negatiivne laeng tehti kindlaks. Seda väikseimat laengut võetakse kui ühtsust = -1.
Thomson määras ka selle massi, mis on võrdne 1/1840 vesinikuaatomi massist.
3. Radioaktiivsus on nähtus, mille avastas A. Becquerel. Radioaktiivseid kiiri on 3 tüüpi:
a) α - kiired, mis koosnevad α - osakestest laenguga +2 ja massiga 4;
b) β - kiired - elektronide voog; c) γ - kiired - elektromagnetlained.
Seetõttu on aatom jagatav ja sellel on keeruline struktuur.
Tabel 1Aatomi planetaarmudel (Rutherford)
TuumVõrdne nukleonite arvuga (prootonite ja neutronite summa)
1) lk + (mass = 1 ja laeng = +1)
Nende arv on võrdne elemendi numbriga;
2) n 0 (mass = 1 ja laeng = 0)
Nende arvN = A r – Z. ( Zon prootonite arv)
Elektrooniline kest
Koosneb elektronidest
(mass kipub nulli ja laeng = -1);
Nende arv on võrdne elemendi numbriga.
Kogu aatomi mass on koondunud tuuma
Aatom on elektriliselt neutraalne
Aatom - elektriliselt neutraalne interakteeruvate elementaarosakeste süsteem, mis koosneb tuumast (moodustuvad prootonitest ja neutronitest) ja elektronidest
Aatomite elektronkestade struktuur
Aatomi elektronkihi mõiste ja energiatasemed
1. Elektrooniline kest – elektronide kogum, mis ümbritseb aatomituuma.
2. Elektronkihis eristatakse kihte, millel paiknevad erineva energiavaruga elektronid, neid nimetatakse nn.energiatasemed . Nende tasemete arv on võrdne perioodi arvuga perioodilisuse tabelis.
3. Tuuma ümbritsevat ruumi, milles elektron kõige tõenäolisemalt leidub (umbes 90%), nimetatakseorbitaal .
Orbitaalide suurus ja kuju
Riis. 1 S-, p- ja d-orbitaalide kujundid1) s 2 - elektronid; sfääriline, tuuma suhtes sümmeetriline ja sellel puudub suund.
2) lk 6 - elektronid; hantlikujuline, paikneb aatomis üksteisega risti
On keerulisema kujuga orbitaale:d 10 - orbitaalid jaf 14 - orbitaalid.
Aatomi energiatasemete (elektrooniliste kihtide) arv on võrdne perioodinumbriga D.I. Mendelejev, kuhu keemiline element kuulub: esimese perioodi elementide aatomitel on üks energiatase, teisel perioodil - kaks, kolmandal perioodil - kolm, seitsmendal perioodil - seitse.
Suurim elektronide arv energiatasemes määratakse järgmise valemiga:
N = 2 n 2 , KusN- maksimaalne elektronide arv;
n- taseme number või peamine kvantarv. (Täisarvn, mis tähistab energiataseme numbrit, nimetataksepeamine kvantarv ).
Aatomi energiatasemed ja elektrooniline konfiguratsioon
Aatomil on keeruline struktuur. See koosneb tuumast, mis sisaldab prootoneid ja neutroneid, ning elektronidest, mis tiirlevad ümber aatomituuma. Prootoni laeng on +1 ja mass on 1 c.u. Neutron on elektriliselt neutraalne osake, mille mass on ligikaudu 1.e. Elektron - laeng on -1, mass 5,5∙10 -4 c.u. Üldiselt on aatom elektriliselt neutraalne, prootonite arv aatomi tuumas on võrdne elektronide arvuga aatomis. Aatomis olevad elektronid jaotuvad energiatasemetel.
Aatomi energiatasemete arv määratakse perioodi arvu järgi, milles element paikneb. Aatomite elektrooniliste mudelite ehitamisel tuleb meeles pidada, et maksimaalne elektronide arv energiatasemel on 2n 2 , Kusn– energiataseme number. Vastavalt sellele ei tohi tuumale lähimal esimesel tasemel olla rohkem kui 2 elektroni, teisel - mitte rohkem kui 8, kolmandal - mitte rohkem kui 18, neljandal - mitte rohkem kui 32. väline energiatase seal ei tohi olla rohkem kui 8 elektroni.
Aatomi neeldumis- ja emissioonispektrid näitavad selgelt, et kõigil aatomitel on mitu võimalikku energiaolekut, mida nimetatakse maapealseks ja ergastatud elektrooniliseks olekuks (joonis 1).
Aatomis olevate elektronide jaotuse registreerimist elektrooniliste tasandite ja alamtasandite vahel nimetatakse selle elektrooniliseks konfiguratsiooniks ja seda saab teha nii aatomi põhi- kui ka ergastatud oleku jaoks. Põhiolekus oleva aatomi spetsiifilise elektroonilise konfiguratsiooni määramiseks on järgmised kolm sätet:
Täitmise põhimõte (väikseim energiakulu). Põhiolekus olevad elektronid täidavad orbitaale järjest suurenevate orbiidi energiatasemetega. Madalaima energiaga orbitaalid täidetakse alati esimesena.
Pauli põhimõte. Ühelgi orbitaalil ja vastassuunaliste spinnidega ei saa olla rohkem kui kaks elektroni (spin on elektroni eriomadus, millel pole makrokosmoses analooge, mida võib lihtsustada kui elektroni pöörlemist ümber oma telje).
Gundi reegel. Degenereerunud (sama energiaga) orbitaalid täidetakse üksikute samade spinnidega elektronidega, alles pärast seda täidetakse degenereerunud orbitaalid Pauli põhimõttel vastandspinnidega elektronidega.
kvantarvud
Peamine kvantarv n samaväärne Bohri teooria kvantarvuga. Põhimõtteliselt määrab see elektronide energia antud orbitaalil.
.....
....
Orbitaalkvantarv l määrab elektroni impulsi orbiidi nurkimpulsi väärtuse antud orbitaalil. Kehtivad väärtused: 0, 1, 2, 3, ... , n-1.
See kvantarv kirjeldab aatomiorbitaali käitumist aatomituumale keskendunud koordinaatsüsteemi pöörlemisel.
Orbitaalne magnetkvantarv m l määrab elektroni nurkimpulsi projektsiooni komponendi väärtuse ruumis valitud suunas. Välise magnetvälja puudumisel orbitaalidel olevad elektronid, millel on sama orbitaalkvantarvu väärtusl on energeetiliselt samaväärsed (st nende energiatase on degenereerunud).
Konstantses magnetväljas aga mõned spektrijooned lõhenevad. See tähendab, et elektronid muutuvad energeetiliselt ebavõrdseks. Näiteks p-olekud magnetväljas võtavad ühe asemel 3 väärtust, d-olekud aga 5 väärtust. Lubatud väärtused m l selle jaoksl : - l , ... -2, -1, 0, +1, +2, ... + l
Pöörlemiskvantarv m s elektroni sisemise magnetmomendi olemasolu tõttu. Üldiselt langeb impulsi magnetmomendi avaldis kokku orbitaalmomendi omaga:
Elektroni m s võtab ainult kaks väärtust: +1/2 ja -1/2. Mõnikord kasutatakse spinni mõiste visuaalsemaks selgitamiseks jämedat analoogiat – elektroni kujutatakse lendava tipuna (ringvooluna, mis loob oma magnetvälja). See analoogia võimaldab selgitada spinni olemasolu 1/2 elektroni ja prootoni jaoks, kuid mitte neutroni jaoks, on nulllaenguga osakesed.
Mõiste "spin" ei sobitu meie ruumi "makroesitustesse". Kõigi selle registreerimismeetodite korral on spinn alati suunatud piki telge, mille vaatleja on algseks valinud. Spinni väärtus 1/2 tähendab, et elektron (prooton, neutron) muutub iseendaga identseks pöörlemisel 720 0 , mitte 360 0 nagu meie 3D maailmas. Spinni peetakse looduse üheks põhiomaduseks (st see ei ole tuletatav, nagu gravitatsioon ja elekter).
Iga orbitaal on tähistatud ruudukujulise rakuga, elektronid vastassuunaliste nooltega (vt selleteemaliste harjutuste lahendust)
Elektrooniline valem on valem, mis näitab elektronide jaotust aatomi elektronikihtidel.
tabel 2
Peamine kvantarv, orbitaalide tüübid ja arv, elektronide maksimaalne arv alamtasanditel ja tasanditel
Energiatase(perioodi number)
n
Alamtasandite arv on võrdne n
Orbitaalide kuju (tüüp).
Orbitaalide arv
Maksimaalne elektronide arv
alamtasandil
tasemel, mis on võrdne n 2
alamtasanditel
tasemel
TO (n=1)
1 s
Praktiline töö
Töö eesmärk:
6) Järeldus
Ülesanne number 1
5. Elektronide arvN ē6 . Laeaatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
a) rühmade kaupa
b) perioodi järgi
Ülesanne number 2
1) elemendi aatomi elektronvalem, vastavalt elektronide arvule välistasandil, metallilise ja mittemetallilise iseloomuga (kui välistasandil on 1-3 elektroni, siis on element metall, kui rohkem kui 3, siis on element mittemetall;
2) elemendi aatomi valentskesta elektrooniline struktuurivalem, aatomi normaal- ja ergastatud olek, negatiivne ja positiivne oksüdatsiooniaste lk - elemendid (mittemetallid), metallide kõrgeim ja madalaim positiivne oksüdatsiooniaste ( s - Ja d - perekonnad);
3) vesinikuühendi valem (ees s -element hüdriid koos H - , Sest lk - gaasilise vesiniku ühend H-ga + ), nimi;
4) oksiidide valemid, milles avalduvad positiivsed oksüdatsiooniastmed, nimetus, olemus;
5) oksiididele vastavate aluste ja hapete valemid, nimetus; soola valemid, nimi.
Iseloomulik lk - element S - väävel, mis asub III põhialagrupi periood VI rühmad
1) 16 S 1 s 2 2 s 2 2 lk 6 3 s 2 3 lk 4 - mittemetall, kuna välistasandil on aatomil rohkem kui kolm elektroni - kuus
2) S 3 s 2 3 lk 4 p - element
↓ aatomi normaalolek on 2 paarita elektroni, seegaSväävel
S ↓ 3r 4 sellel on negatiivne oksüdatsiooniaste (-2):
3 s 2 S 0 + 2 ē →S -2
S * esimene ergastatud olek on 4 paarita elektroni, seegaS
3 d 1 sellel on positiivne oksüdatsiooniaste (+4):
↓ 3 lk 3 S 0 - 4 ē →S +4
3 s 2
teine ergastatud olek on 6 paarita elektroni, seega
3 d 2 väävel on positiivse oksüdatsiooniastmega (+6):
S ** 3 lk 3 S 0 - 6 ē →S +6
3 s 1
3) S -2 → H 2 S- vesiniksulfiid, mille vesilahus on vesiniksulfiidhape.
soolaH 2 Snimetatakse sulfiidideks; (nimi) K 2 S- kaaliumsulfiid.
4) S +4 → NII 2 (vääveloksiidIV) → hapeH 2 NII 3 → sool:
TO 2 NII 3 ja KNNII 3
5) S +6 → NII 3 (vääveloksiidVI) → hapeH 2 NII 4 → sool: K 2 NII 4 ja KNNII 4
Iseloomulik s - element Ca - kaltsium, on teise rühma peamise alarühma neljandas perioodis
1) 20 Sa 1 s 2 2 s 2 2 lk 6 3 s 2 3 lk 6 4 s 2 Kkaltsium on metall, kuna välistasandil on aatomil vähem kui kolm elektroni - 2 elektroni
2) Sa 4 s 2 s- element; Sa 4s 2 - aatomi normaalne olek - pole paarituid elektrone
Sa * aatomi ergastatud olek on kaks paaritut elektroni, seega
Sa 0 - 2 ē → Sa +2
4p 1 Ca - avaldab positiivset oksüdatsiooniastet (+2);negatiivne aste
4 s 1 metallid ei oksüdeeru
3) Sa +2 H 2 - - vesinikühendus; SaN 2 (kaltsiumhüdriid)
4) Sa +2 → oksiid CaO → alus Ca(OH) 2 → sool: 1) caCI 2 ja SaonCI 2) CaSO 3 JaCa(HSO 3 ) 2
Ülesanne number 3
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
s-element
R- element
Järeldus:
Praktiline töö
valik 1
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem ja nende iseloom
Ülesanne number 2
Elemendi karakteristikud selle asendi järgi perioodilisuse süsteemis näitavad elemendi aatomi valentsivõimalusi
Ülesanne number 3 Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valemid
s-element
p-element
Järeldus:
Praktiline töö
2. variant
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
Ülesanne number 2
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Praktiline töö
3. võimalus
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
Ülesanne number 2
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Praktiline töö
4. võimalus
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Töö eesmärk:
1) Õppige iseloomustama elemente nende asukoha järgi perioodilisuse süsteemis
2) Rakendada teadmisi aatomi ehitusest keemiliste elementide aatomite tunnuste koostamisel
3) Kirjutage üles elemendi elektrooniline valem
4) Määrake kõrgema oksiidi ja hüdroksiidi valem ja olemus; selle vesinikuühend
5) Esitage võrdlev kirjeldus perioodi ja rühma naaberelementidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
Ülesanne number 2
Iseloomustades elementi selle positsiooni järgi perioodilises süsteemis, märkige:
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Praktiline töö
5. võimalus
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Töö eesmärk:
1) Õppige iseloomustama elemente nende asukoha järgi perioodilisuse süsteemis
2) Rakendada teadmisi aatomi ehitusest keemiliste elementide aatomite tunnuste koostamisel
3) Kirjutage üles elemendi elektrooniline valem
4) Määrake kõrgema oksiidi ja hüdroksiidi valem ja olemus; selle vesinikuühend
5) Esitage võrdlev kirjeldus perioodi ja rühma naaberelementidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
(happed ja soolad – lämmastik- ja lämmastikhappe näitel)
Ülesanne number 2
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Praktiline töö
6. võimalus
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Töö eesmärk:
1) Õppige iseloomustama elemente nende asukoha järgi perioodilisuse süsteemis
2) Rakendada teadmisi aatomi ehitusest keemiliste elementide aatomite tunnuste koostamisel
3) Kirjutage üles elemendi elektrooniline valem
4) Määrake kõrgema oksiidi ja hüdroksiidi valem ja olemus; selle vesinikuühend
5) Esitage võrdlev kirjeldus perioodi ja rühma naaberelementidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
(happed ja soolad - näiteksS)
Ülesanne number 2
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Praktiline töö
7. valik
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Töö eesmärk:
1) Õppige iseloomustama elemente nende asukoha järgi perioodilisuse süsteemis
2) Rakendada teadmisi aatomi ehitusest keemiliste elementide aatomite tunnuste koostamisel
3) Kirjutage üles elemendi elektrooniline valem
4) Määrake kõrgema oksiidi ja hüdroksiidi valem ja olemus; selle vesinikuühend
5) Esitage võrdlev kirjeldus perioodi ja rühma naaberelementidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
(happed ja soolad - näiteksS)
Ülesanne number 2
Iseloomustades elementi selle positsiooni järgi perioodilises süsteemis, märkige:
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Praktiline töö
8. valik
Elementide aatomite elektrooniliste valemite ja graafiliste skeemide koostamine, nende täitmine elektronidega
Töö eesmärk:
1) Õppige iseloomustama elemente nende asukoha järgi perioodilisuse süsteemis
2) Rakendada teadmisi aatomi ehitusest keemiliste elementide aatomite tunnuste koostamisel
3) Kirjutage üles elemendi elektrooniline valem
4) Määrake kõrgema oksiidi ja hüdroksiidi valem ja olemus; selle vesinikuühend
5) Esitage võrdlev kirjeldus perioodi ja rühma naaberelementidega
Edusammud
Ülesanne number 1
Täida tabel:
5. Elektronide arvN ē6 . Lae aatomi tuumad, Z
7. Massiarv, A
8. neutronite arv,N n 0 = A -N R +
9. Kirjutage elektronide jaotus energiatasemete järgi
10. Võrdlus naabritega:
a) rühmade kaupa
b) perioodi järgi
11. Kõrgema oksiidi ja hüdroksiidi valem
(hape - boor, soolad - boraadid)
Ülesanne number 2
Iseloomustades elementi selle positsiooni järgi perioodilises süsteemis, märkige:
Sisestage töö tulemused tabelisse järgmisel kujul:
Vorm ēelement
Element
Valents
kest
Madalaim oksüdatsiooniaste
Vesiniku ühend
Vahepealsed oksüdatsiooniastmed
Kõrgeim oksüdatsiooniaste
Ülim oksiidvalem
Hüdroksiidi valem
Soola valem
Järeldus:
Populaarne
- Põllumajanduse ja töötleva tööstuse päeva tähistamine
- Millal tähistatakse põllumajanduspäeva?
- Kaardimängud laua taga
- Naljakad ja naljakad võistlused lõbusale täiskasvanute seltskonnale
- Poola "langevarjurid" Nõukogude merejalaväelastele
- Projekt 205 raketipaadid
- Kuidas läheb elu uuel Hiina hävitajal
- Uusim fregatt "Laevastiku Admiral Kasatonov" valmistub esimesteks katseteks ja läheb merele Laev Admiral Kasatonov
- Gato tüüpi allveelaevad
- NSV Liidu II rühma üksuse kaubalaevastiku sümboolika