Applicazione della presentazione di anidride carbonica. Presentazione sul tema "Anidride carbonica (CO2)"
diapositiva 2
Diossido di carbonio
L'anidride carbonica è incolore e inodore. È quasi 1,5 volte più pesante dell'aria. In condizioni normali, un volume di anidride carbonica si dissolve in un volume di acqua.
diapositiva 3
L'aria contiene sempre circa lo 0,3% di anidride carbonica. Il suo contenuto nell'aria è instabile. L'aria nelle città, specialmente vicino agli impianti e alle fabbriche, contiene un po' più di anidride carbonica dell'aria nelle zone rurali.
diapositiva 4
L'anidride carbonica si forma durante la respirazione e la combustione del carburante, nonché durante la combustione e il decadimento di varie sostanze organiche.
L'acqua di molte sorgenti minerali contiene una quantità significativa di anidride carbonica disciolta. Una di queste fonti di acqua minerale si trova a Kislovodsk. Ogni giorno questa primavera esce circa due milioni e mezzo di litri di acqua minerale contenente fino a 5 g di anidride carbonica libera.
diapositiva 5
Le acque dei mari e degli oceani contengono molta anidride carbonica disciolta, dieci volte di più che nell'aria.
diapositiva 6
Quando la pressione viene aumentata a 60 atm, si trasforma in un liquido incolore. Quando l'anidride carbonica liquida evapora, parte di essa può trasformarsi in una massa solida simile alla neve. Viene pressato e si ottiene il cosiddetto "ghiaccio secco", che sublima a pressione normale senza sciogliersi, e la sua temperatura scende a -78,5°C. Pertanto, il ghiaccio secco viene utilizzato principalmente per la conservazione prodotti alimentari e soprattutto il gelato.
Proprietà chimicheLe proprietà chimiche dell'anidride carbonica sono
ossidi acidi. Quando disciolto in acqua, si forma
acido carbonico. Reagisce con gli alcali formando
carbonati e idrocarburi. entra in reazioni
sostituzione elettrofila (ad esempio con fenolo) e
addizione nucleofila (ad esempio, con
composti organomagnesiaci). Proprietà fisiche
Monossido di carbonio (IV) - anidride carbonica, gas inodore e incolore,
per forte raffreddamento cristallizza come un bianco
massa simile alla neve - "ghiaccio secco". In atmosfera
pressione, non si scioglie, ma evapora, la temperatura di sublimazione
-78 °С. L'anidride carbonica si forma durante la decomposizione e la combustione
sostanze organiche. Contenuto nell'aria e minerale
fonti, viene rilasciato durante la respirazione di animali e piante.
Solubile in acqua (1 volume di anidride carbonica in un volume
acqua a 15°C). Applicazione
Nel cibo
industria
diossido di carbonio
usato come
conservante e
lievito in polvere,
denotato da
confezione per codice
E290 Anidride carbonica
è usato per
limonata gassata e
acqua gassata. L'anidride carbonica liquida è ampiamente utilizzata nei sistemi
estintori ed estintori. acido carbonico dentro
bombolette spray
applicato in
pistola ad aria
(in mongolfiera
pneumatica) e come
fonte di energia per
motori dentro
aeromodellismo. L'anidride carbonica solida - "ghiaccio secco" - è usata come
refrigerante negli studi di laboratorio, in vedere al dettaglio, A
riparazione dell'attrezzatura (ad esempio: raffreddamento di uno degli accoppiamenti
parti durante l'atterraggio in tensione), ecc. Per liquefare l'anidride carbonica e
il ghiaccio secco viene prodotto utilizzando impianti ad anidride carbonica. Ruolo negli organismi viventi e
influenza su di loro
L'anidride carbonica viene prodotta bruciando o
decadimento della materia organica. monossido di carbonio
contenuti nell'aria e nei minerali sotterranei
fonti. Anche gli esseri umani e gli animali emettono
anidride carbonica quando espiri aria. Piante senza
l'illuminazione lo rilascia e durante la fotosintesi
assorbire intensamente. Grazie al processo
metabolismo cellulare di tutti gli esseri viventi ossido
il carbonio è uno dei costituenti principali
natura circostante. Questo gas non è tossico, ma se si accumula in un grande
concentrazione, può iniziare il soffocamento (ipercapnia) e quando
la carenza sviluppa lo stato opposto -
ipocapnia. L'anidride carbonica trasmette l'ultravioletto
irradia e riflette gli infrarossi. È un gas serra
che contribuisce direttamente al riscaldamento globale. Questo
è dovuto al fatto che il livello del suo contenuto nell'atmosfera
in costante crescita, che porta all'effetto serra. Fatti interessanti
scienziato inglese Joseph Priestley nel 1767
si interessò alla natura delle bolle,
che vengono in superficie a
fermentazione della birra. Sopra la vasca della birra
mise una ciotola d'acqua, che era allora
L'ho assaggiato e l'ho scoperto
ha un effetto rinfrescante. Priestley
scoperto nient'altro che anidride carbonica,
che viene utilizzato ancora oggi
produzione di bevande gassate. Attraverso
cinque anni prima Priestley pubblicò un'opera in
che descriveva un metodo più avanzato
producendo anidride carbonica per reazione
acido solforico con gesso. Il fatto sorprendente è che non solo una persona può esserlo
in uno stato di ebbrezza. Gli scienziati lo hanno scoperto
un simile comportamento "ubriaco" si verifica nei pesci. Si ubriacano e basta
dall'alcool, ma dall'anidride carbonica.
Gli abitanti dell'oceano perdono letteralmente la testa se nell'acqua
la concentrazione di CO2 aumenta Violazione del coordinamento e
la scomparsa del senso di pericolo ne sono le principali manifestazioni
stati.
Questo strano fenomeno è stato scoperto da un ricercatore
Università John Cook di Philip Mandey. Ha sperimentato
con i pesci di barriera mettendoli in acquari che sono stati
aumento del contenuto di CO2. E il pesce sperimentale ha iniziato a guidare
stessi in modi inaspettati, ad esempio, nuotavano sugli odori dei predatori.
Göran Nilsson (un collega del ricercatore di Oslo) lo ha suggerito
l'anidride carbonica, quando interagisce con l'acqua dell'oceano, aumenta la sua
acidità. Pertanto, l'equilibrio chimico del pesce è disturbato a causa del fatto che
di cui hanno bisogno per mantenere una maggiore concentrazione di ioni
dentro le cellule. Di conseguenza, viene creato un effetto che ricorda molto
ubriachezza e iniziano a comportarsi in modo inappropriato. La casa media emette il doppio di anidride carbonica rispetto alla casa media
automobile. Il ghiaccio secco prende il nome dalla sua somiglianza con il ghiaccio normale.
ghiaccio. Ma non è una forma solida
acqua, ma anidride carbonica (CO2),
che è inodore, insapore e
colori. Temperatura del ghiaccio secco
è -78,5 gradi Celsius.
Molto spesso è usato per
raffreddare il gelato o
generatori di nebbia sui set cinematografici
siti. Evaporazione del ghiaccio secco
si trasforma di nuovo in gas, si raffredda
aria e causare condensa
vapore acqueo, che crea
"effetto nebbia" Il contenuto naturale di anidride carbonica nell'atmosfera è cambiato da
nel corso della storia tra 180 e 300 ppm
(promille). Oggi i livelli di CO2 si aggirano intorno a 380
ppm, che è il 25% in più rispetto al tasso più alto in
ambiente naturale.
Nel 1997 il contenuto di CO2 nell'atmosfera è aumentato di 2,87
ppm questo aumento era più di qualsiasi altro
un altro anno di storia moderna.
Dalle viscere della Terra arrivano molti vapori naturali, vapori
acqua, grandi quantità di anidride carbonica (CO2) e altri gas,
che, una volta rilasciato nell'atmosfera, assorbe energia solare E
irradiarlo in rovescio. Questo tipo di riscaldamento è chiamato
"effetto serra naturale". "Effetto serra",
contro ogni previsione, provoca il cambiamento climatico globale
a causa di un aumento della concentrazione di CO2 nell'atmosfera del nostro pianeta. Lo scienziato svedese Svante Arrhenius nel 1896
capito quello attività produttiva umano
supera già la capacità naturale della terra
assorbimento di anidride carbonica
Combustione attuale di combustibili fossili
aggiunge circa sei miliardi di tonnellate di anidride carbonica
gas nell'atmosfera del nostro pianeta ogni anno. Soltanto
metà dei gas di queste emissioni vengono riciclati
foreste e oceani.
La massiccia deforestazione è la causa del 20%
il riscaldamento globale a causa dell'inquinamento da gas,
inibendo il riassorbimento di anidride carbonica. L'atmosfera terrestre contiene attualmente il 40% in più di CO2 rispetto a
prima della rivoluzione industriale.
La popolazione degli Stati Uniti è il 5% della comunità mondiale,
ma la nazione americana crea domanda per il 25% del consumo commerciale
energia nel mondo e produce il 22% delle emissioni industriali di anidride carbonica
gas, rispetto al mondo.
Circa il 75% dell'aumento annuale del contenuto di anidride carbonica in
l'atmosfera è caratterizzata dalla combustione di combustibili fossili.
Più del 20% delle emissioni di anidride carbonica proviene dalla benzina
motori di automobili. Sebbene la leadership nel danno ambientale sia ancora
di proprietà di centrali elettriche a combustibili fossili.
Un aumento significativo di CO2 nell'atmosfera può ovviamente aumentare
temperatura, ma non tanto quanto il vapore acqueo, la cui proporzione è
oltre il 90% nei componenti principali per creare un effetto serra.
Per utilizzare l'anteprima delle presentazioni, crea un account per te stesso ( account) Google e accedi: https://accounts.google.com
Didascalie delle diapositive:
Ossidi di carbonio Insegnante di chimica MOU "KSOSH n. 7" Gareeva O.I.
Ottenere monossido di carbonio (II) Metodo industriale 1. Si forma durante la combustione di carbonio o composti a base di esso (ad esempio benzina) in condizioni di mancanza di ossigeno: 2C + O 2 = 2CO 2. Quando monossido di carbonio (IV) si riduce con il carbone ardente: CO 2 + C = 2CO Questa reazione avviene spesso nei fuochi delle fornaci.
Ottenere monossido di carbonio (IV) 1. Nell'industria si ottengono arrostendo carbonati naturali (calcare, dolomite). CaCO 3 \u003d CaO + CO 2 2. In condizioni di laboratorio, si ottiene dall'interazione di carbonati e bicarbonati con acidi, ad esempio marmo, gesso o soda con acido cloridrico: CaCO 3 + 2HCI \u003d CaCI 2 + H 2 O + CO 2 Può essere utilizzato per far reagire bicarbonato di sodio con acido citrico o succo di limone acido.
Proprietà fisiche CO - monossido di carbonio (II), monossido di carbonio, monossido di carbonio Gas, incolore, inodore, più leggero dell'aria, leggermente solubile in acqua, molto meglio solubile in alcool, T. pl. -205.02 0 C, bp -191,5 densità 1,25 g/l (0 0 C) Molto velenoso! CO 2 - monossido di carbonio (IV), anidride carbonica, anidride carbonica. Gas, incolore, inodore, 1,5 volte più pesante dell'aria, solubile in acqua, densità 1,98 g/l So pl. −57 °C), T, kip −78 °C, sublima. L'ossido solido è chiamato "ghiaccio secco"
Proprietà chimiche del monossido di carbonio (II) A temperatura ambiente, la CO è inattiva, la sua attività chimica aumenta significativamente quando riscaldata e in soluzioni la CO è un ossido non formante sale 1. Quando riscaldata, riduce i metalli dagli ossidi: CO + CuO → Cu + CO 2 2. Brucia blu nella fiamma dell'aria (temperatura di inizio reazione 700 °C): 2 CO + O 2 → 2CO 2 + Q La temperatura di combustione del CO può raggiungere i 2100 °C.
Proprietà chimiche del monossido di carbonio (IV) CO 2 - ossido acido 1. Interagisce con l'acqua, formando acido carbonico instabile (reazione reversibile) CO 2 + H 2 O H 2 CO 3 2. Interagisce con alcali, formando carbonati e bicarbonati CO 2 + Ca (OH) 2 \u003d CaCO 3 ↓ + H 2 O CaCO 3 + CO 2 + H 2 O \u003d Ca (HCO 3) 2 3. Interagisce con ossidi basici CO 2 + CaO \u003d CaCO 3
L'uso del monossido di carbonio (II) Come agente riducente, il CO viene utilizzato nella metallurgia per la fusione del ferro.
Il gas d'acqua viene utilizzato come combustibile e viene anche utilizzato nella sintesi chimica - per ottenere ammoniaca, alcoli superiori, ecc.
Il monossido di carbonio (II) viene utilizzato per trattare carne animale e pesce, conferendo loro un colore rosso vivo e un aspetto fresco, senza alterare il gusto.La concentrazione ammissibile di CO è di 200 mg/kg di carne.
L'uso del monossido di carbonio (IV) L'anidride carbonica viene utilizzata per carbonare la frutta e acque minerali, per la produzione di zucchero, in medicina per bagni carbonici.
Nell'industria alimentare, il monossido di carbonio (IV) viene utilizzato come conservante ed è indicato sulla confezione con il codice E290, così come un lievito per pasta.
Le bombole ad anidride carbonica liquida trovano largo impiego come estintori 1) negli estintori portatili; 2) negli impianti antincendio di aeromobili e navi, autopompe ad anidride carbonica. L'uso così diffuso nell'estinzione degli incendi è dovuto al fatto che in alcuni casi l'acqua non è adatta allo spegnimento.
Tecnologie per la pulizia di varie superfici con granuli di "ghiaccio secco". Pulizia stampi ad iniezione con "ghiaccio secco"
L'anidride carbonica solida - ghiaccio secco - viene utilizzata nei ghiacciai. L'anidride carbonica liquida viene utilizzata come refrigerante e fluido di lavoro in frigoriferi, congelatori e generatori di energia solare.
Gli scienziati hanno trovato un modo per utilizzare l'anidride carbonica: può essere utilizzata per produrre policarbonato, che viene utilizzato per creare CD. I primi DVD e bottiglie di plastica da CO 2 potrebbe apparire in vendita tra un paio d'anni.
Il significato biologico dell'anidride carbonica Il monossido di carbonio (IV) svolge uno dei ruoli principali nella fauna selvatica, partecipando a molti processi metabolici di una cellula vivente. L'anidride carbonica atmosferica è la principale fonte di carbonio per le piante. Le piante assorbono anidride carbonica durante la fotosintesi,















1 di 15
Presentazione sul tema: Diossido di carbonio
diapositiva numero 1

Descrizione della diapositiva:
diapositiva numero 2

Descrizione della diapositiva:
diapositiva numero 3

Descrizione della diapositiva:
Proprietà fisiche Il monossido di carbonio (IV) è un gas incolore, circa 1,5 volte più pesante dell'aria, altamente solubile in acqua, inodore, non infiammabile, non favorisce la combustione, provoca soffocamento. Sotto pressione si trasforma in un liquido incolore che si solidifica raffreddandosi.
diapositiva numero 4

Descrizione della diapositiva:
Formazione di monossido di carbonio (IV) Nell'industria, un sottoprodotto della produzione di calce. In laboratorio - quando gli acidi interagiscono con il gesso o il marmo. Quando si bruciano sostanze carboniose. Con lenta ossidazione nei processi biochimici (respirazione, decadimento, fermentazione).
diapositiva numero 5

Descrizione della diapositiva:
diapositiva numero 6

Descrizione della diapositiva:
Catturiamo il fumo La combustione è associata alla comparsa del fumo. Il fumo è bianco, nero e talvolta invisibile. Sopra una candela calda o una lampada a spirito si alza un tale fumo "invisibile" chiamato anidride carbonica. Tieni una provetta pulita sopra la candela e cattura un po' di fumo "invisibile". Per evitare che voli via, chiudi velocemente la provetta con un tappo di sughero senza foro. L'anidride carbonica sarà invisibile in una provetta. Conserva questo tubo di anidride carbonica per futuri esperimenti.
diapositiva numero 7

Descrizione della diapositiva:
"Storia fangosa" Versa dell'acqua di calce (per coprire il fondo) nella provetta in cui hai catturato l'anidride carbonica dalla fiamma della candela. Chiudere il flaconcino con il dito e agitarlo. L'acqua limpida e calcarea divenne piuttosto torbida. La colpa è solo dell'anidride carbonica. Se prendi acqua di calce in una provetta che non conteneva anidride carbonica e agiti la provetta, l'acqua rimarrà limpida. Ciò significa che la torbidità dell'acqua di calce è la prova che c'era anidride carbonica nella provetta.
diapositiva numero 8

Descrizione della diapositiva:
L'anidride carbonica viene rilasciata dalla soda Prendi un po' di polvere di soda e scaldala in una provetta rinforzata orizzontale. Collegare questo tubo con un tubo a gomito ad un altro tubo contenente acqua. Le bolle inizieranno a fuoriuscire dal tubo. Pertanto, una sorta di gas entra nell'acqua dalla soda. Non lasciare che il tubo di vetro venga abbassato nell'acqua dopo la fine del riscaldamento, altrimenti l'acqua salirà attraverso il tubo e cadrà nella provetta calda con la soda. Ciò potrebbe causare lo scoppio del tubo. Dopo aver visto che il gas viene rilasciato dalla soda quando riscaldato, prova a sostituire l'acqua naturale nella provetta con acqua di calce. Diventerà noiosa. La soda rilascia anidride carbonica.
diapositiva numero 9

Descrizione della diapositiva:
Anche il gas della limonata è anidride carbonica: se apri una bottiglia di limonata o inizi a scuoterla, appariranno molte bolle di gas. Chiudi la bottiglia di limonata con un tappo di sughero in cui è inserito un tubo di vetro e immergi l'estremità lunga del tubo in una fiala di acqua di calce. Presto l'acqua diventerà torbida. Quindi il gas limone è anidride carbonica. È formato dall'acido carbonico contenuto nella limonata.
diapositiva numero 10

Descrizione della diapositiva:
L'aceto espelle l'anidride carbonica dalla soda L'anidride carbonica è contenuta in numerose sostanze, ma è impossibile determinarla a occhio. Se versi dell'aceto su un pezzo di bicarbonato di sodio, l'aceto sfrigolerà violentemente e il bicarbonato rilascerà un po' di gas. Se metti un pezzo di soda in una provetta, ci versi dell'aceto, la chiudi con un tappo di sughero con un tubo a gomito e immergi l'estremità lunga del tubo nell'acqua di calce, sarai convinto che anche l'anidride carbonica viene rilasciata dalla soda.
Descrizione della diapositiva:
Limonata in tasca L'anidride carbonica nelle bevande aumenta il loro effetto rinfrescante. Puoi fare un limone schiumoso in qualsiasi momento. Per fare questo, mescola 2 centimetri cubi di polvere di acido citrico, 2 centimetri cubi di soda e 6 centimetri cubi di zucchero a velo in una provetta. Queste tre sostanze devono essere accuratamente miscelate, agitate e versate su un grande foglio di carta. Questo importo deve essere diviso in parti uguali. Ogni porzione dovrebbe essere abbastanza grande da coprire il fondo rotondo del tubo. Avvolgi ogni porzione in un pezzo di carta separato, poiché le polveri sono avvolte in una farmacia. Da una di queste borse puoi prendere un bicchiere di limonata rinfrescante.
diapositiva numero 13

Descrizione della diapositiva:
Il calcare emette anidride carbonica Se la schiuma appare quando una sostanza viene bagnata con l'acido, ciò è quasi sempre dovuto all'anidride carbonica rilasciata. È lui che forma questa schiuma. Il calcare bagnato sibila e schiume, da esso viene rilasciata anidride carbonica. Se non sei sicuro di questo, fai un esperimento: metti un pezzo di calcare in una provetta e aggiungi acido, quindi chiudi la provetta con un tappo con un tubo di vetro e immergi l'estremità lunga di questo tubo in acqua di calce. L'acqua diventa torbida. Esistono diversi tipi di calce. Il calcare è carbonato di calcio.
diapositiva numero 14

Descrizione della diapositiva:
Fiamma che affonda L'anidride carbonica riscaldata, o fumo, è leggera e sale liberamente nell'aria, l'anidride carbonica fredda è pesante, si deposita sul fondo del recipiente e gradualmente lo riempie fino all'orlo. Nell'anidride carbonica la combustione è impossibile, poiché è essa stessa un prodotto della combustione. Se metti una candela sul fondo di un vaso e la guardi per un po', vedrai che la fiamma si spegnerà presto. L'anidride carbonica, che è stata trasformata durante l'accensione di una candela, riempirà gradualmente il vaso fino all'orlo e la fiamma "annegherà" nell'anidride carbonica.
diapositiva numero 15

Descrizione della diapositiva:
Fonte di informazioni D. Shkurko, "Funny Chemistry", Leningrado, "Children's Literature", 1976. James Verzeim, Chris Oxlade, "Chemistry. Libro di riferimento illustrato per la scuola, ROSMEN, 1995. F.G. Feldman, G.E. Rudzitis, "Chimica 9. Un libro di testo per il 9 ° grado delle istituzioni educative secondarie", M., "Illuminismo", 1994. Fonti di illustrazioni http://www.tonis.ua/content/news/thumbnail/320x240/349. jpg http: //img.lenta.ru/news/2006/10/27/morgan/picture.jpg http://edwinfotografeert.files.wordpress.com/2010/10/co2-brand.jpg?w=300&h= 214 http: //him.1september.ru/2004/36/23-1.jpg http://www.3dnews.ru/_imgdata/img/2009/11/22/150662.jpg http://img.lenta .ru/ science/2004/10/11/carbon/picture.jpg http://img1.liveinternet.ru/images/attach/c/3/75/324/75324927_660779_kopiya.gif http://www.qualenergia.it /sites/ default/files/articolo-img/CO2_anidride_carbonica_carbon_bomba.jpg?1297712324 http://www.blackpantera.ru/upload/iblock/9c9/9c99680c814d3904d302dd9f4d42c33b.jpg
diapositiva 1
Diossido di carbonio
diapositiva 2

La struttura della molecola
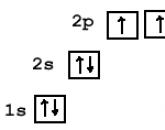
La molecola di CO2 è lineare, la lunghezza del doppio legame C=O è di 0,116 nm. Nell'ambito della teoria dell'ibridazione degli orbitali atomici, due legami σ sono formati da orbitali ibridi sp dell'atomo di carbonio e orbitali 2p dell'atomo di ossigeno. Gli orbitali p del carbonio che non partecipano all'ibridazione formano legami p con orbitali dell'ossigeno simili. La molecola è apolare.
diapositiva 3

Proprietà fisiche
Monossido di carbonio (IV) - anidride carbonica, un gas incolore e inodore, più pesante dell'aria, solubile in acqua, con forte raffreddamento, cristallizza sotto forma di una massa bianca simile alla neve - "ghiaccio secco". A pressione atmosferica non fonde, ma evapora, la temperatura di sublimazione è di -78 ° C. L'anidride carbonica si forma durante il decadimento e la combustione della materia organica. Contenuti nell'aria e nelle sorgenti minerali, rilasciati durante la respirazione di animali e piante. Leggermente solubile in acqua (1 volume di anidride carbonica in un volume di acqua a 15 °C).
diapositiva 4

Proprietà chimiche
Chimicamente, il monossido di carbonio è inerte. 1. Proprietà ossidanti Mostra proprietà ossidanti con forti agenti riducenti ad alte temperature. Il carbone viene ripristinato monossido di carbonio: C + CO2 = 2CO. Il magnesio, acceso in aria, continua a bruciare in un'atmosfera di anidride carbonica: 2Mg + CO2 = 2MgO + C.
diapositiva 5

Proprietà chimiche
2. Proprietà dell'ossido acido Tipico ossido acido. Reagisce con ossidi e basi basici per formare sali di acido carbonico: Na2O + CO2 = Na2CO3, 2NaOH + CO2 = Na2CO3 + H2O, NaOH + CO2 = NaHCO3.
diapositiva 6

Proprietà chimiche
3. Reazione qualitativa La reazione qualitativa per la rilevazione dell'anidride carbonica è la torbidità dell'acqua di calce: Ca(OH)2 + CO2 = CaCO3↓ + H2O. All'inizio della reazione si forma un precipitato bianco, che scompare quando la CO2 viene fatta passare a lungo nell'acqua di calce, perché. il carbonato di calcio insolubile si trasforma in bicarbonato solubile: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Diapositiva 7

Nell'industria, è un sottoprodotto della produzione di calce. In laboratorio quando gli acidi interagiscono con il gesso o il marmo. Quando si bruciano sostanze carboniose. Con lenta ossidazione nei processi biochimici (respirazione, decadimento, fermentazione).
Ricevuta
Diapositiva 8

Ottenere lo zucchero. Estintore. Produzione di acque di frutta. "Ghiaccio secco". Ottenere prodotti per la pulizia. Ottenere farmaci. Ottenere la soda, che viene utilizzata per ottenere il vetro.
Applicazione del monossido di carbonio (IV)
Diapositiva 9

La combustione è associata alla comparsa di fumo. Il fumo è bianco, nero e talvolta invisibile. Sopra una candela calda o una lampada a spirito si alza un tale fumo "invisibile" chiamato anidride carbonica. Tieni una provetta pulita sopra la candela e cattura un po' di fumo "invisibile". Per evitare che voli via, chiudi velocemente la provetta con un tappo di sughero senza foro. L'anidride carbonica sarà invisibile in una provetta. Conserva questo tubo di anidride carbonica per futuri esperimenti.
Stiamo prendendo fumo
Diapositiva 10

"Storia fangosa"
Versa dell'acqua di calce (per coprire il fondo) nella provetta in cui hai catturato l'anidride carbonica dalla fiamma della candela. Chiudere il flaconcino con il dito e agitarlo. L'acqua limpida e calcarea divenne piuttosto torbida. La colpa è solo dell'anidride carbonica. Se prendi acqua di calce in una provetta che non conteneva anidride carbonica e agiti la provetta, l'acqua rimarrà limpida. Ciò significa che la torbidità dell'acqua di calce è la prova che c'era anidride carbonica nella provetta.
diapositiva 11

La soda rilascia anidride carbonica
Prendi del bicarbonato di sodio in polvere e scaldalo in una provetta rinforzata orizzontale. Collegare questo tubo con un tubo a gomito ad un altro tubo contenente acqua. Le bolle inizieranno a fuoriuscire dal tubo. Pertanto, una sorta di gas entra nell'acqua dalla soda. Non lasciare che il tubo di vetro venga abbassato nell'acqua dopo la fine del riscaldamento, altrimenti l'acqua salirà attraverso il tubo e cadrà nella provetta calda con la soda. Ciò potrebbe causare lo scoppio del tubo. Dopo aver visto che il gas viene rilasciato dalla soda quando riscaldato, prova a sostituire l'acqua naturale nella provetta con acqua di calce. Diventerà noiosa. La soda rilascia anidride carbonica.
diapositiva 12

Il gas della limonata è anche anidride carbonica
Se apri una bottiglia di limonata o inizi a scuoterla, appariranno molte bolle di gas. Chiudi la bottiglia di limonata con un tappo di sughero in cui è inserito un tubo di vetro e immergi l'estremità lunga del tubo in una fiala di acqua di calce. Presto l'acqua diventerà torbida. Quindi il gas limone è anidride carbonica. È formato dall'acido carbonico contenuto nella limonata.
diapositiva 13

L'aceto rimuove l'anidride carbonica dal bicarbonato di sodio
L'anidride carbonica contiene in un certo numero di sostanze, ma è impossibile determinarlo a occhio. Se versi dell'aceto su un pezzo di bicarbonato di sodio, l'aceto sfrigolerà fortemente e un po' di gas verrà rilasciato dalla soda. Se metti un pezzo di soda in una provetta, ci versi dell'aceto, la chiudi con un tappo di sughero con un tubo a gomito e immergi l'estremità lunga del tubo nell'acqua di calce, sarai convinto che anche l'anidride carbonica viene rilasciata dalla soda.
Diapositiva 14

fabbrica di limonata
Anche un acido debole espelle l'anidride carbonica dalla soda. Coprire il fondo della provetta con acido citrico e versarvi sopra la stessa quantità di soda. Mescola queste due sostanze. Entrambi vanno d'accordo, ma non per molto. Versare questo composto in un normale bicchiere e riempirlo velocemente con acqua fresca. Quanto sibila e schiuma! Come una vera limonata. Puoi berlo facilmente. È assolutamente innocuo, persino delizioso. Devi solo aggiungere lo zucchero all'inizio, solo per renderlo più gustoso.
diapositiva 15

Limonata in tasca
L'anidride carbonica nelle bevande aumenta il loro effetto rinfrescante. Puoi fare un limone schiumoso in qualsiasi momento. Per fare questo, mescola 2 centimetri cubi di polvere di acido citrico, 2 centimetri cubi di soda e 6 centimetri cubi di zucchero a velo in una provetta. Queste tre sostanze devono essere accuratamente miscelate, agitate e versate su un grande foglio di carta. Questo importo deve essere diviso in parti uguali. Ogni porzione dovrebbe essere abbastanza grande da coprire il fondo rotondo del tubo. Avvolgi ogni porzione in un pezzo di carta separato, poiché le polveri sono avvolte in una farmacia. Da una di queste borse puoi prendere un bicchiere di limonata rinfrescante.
diapositiva 16

Il calcare rilascia anidride carbonica
Se la schiuma appare quando una sostanza viene bagnata con acido, ciò è quasi sempre dovuto al rilascio di anidride carbonica. È lui che forma questa schiuma. Il calcare bagnato sibila e schiume, da esso viene rilasciata anidride carbonica. Se non sei sicuro di questo, fai un esperimento: metti un pezzo di calcare in una provetta e aggiungi acido, quindi chiudi la provetta con un tappo con un tubo di vetro e immergi l'estremità lunga di questo tubo in acqua di calce. L'acqua diventa torbida. Esistono diversi tipi di calce. Il calcare è carbonato di calcio.
Diapositiva 17

fiamma che affonda
L'anidride carbonica calda, o fumo, è leggera e sale liberamente nell'aria, l'anidride carbonica fredda è pesante, si deposita sul fondo della nave e la riempie gradualmente fino all'orlo. Nell'anidride carbonica la combustione è impossibile, poiché è essa stessa un prodotto della combustione. Se metti una candela sul fondo di un vaso e la guardi per un po', vedrai che la fiamma si spegnerà presto. L'anidride carbonica, che si è trasformata durante l'accensione di una candela, riempie gradualmente il vaso fino all'orlo e la fiamma "annega" nell'anidride carbonica.
Popolare
- Celebrazione della giornata dell'agricoltura e dell'industria di trasformazione
- Quando si celebra la Giornata dell'agricoltura?
- Giochi di carte al tavolo
- Concorsi divertenti e divertenti per una divertente compagnia di adulti
- "Paracadutisti" polacchi per i marines sovietici
- Progetto 205 navi missilistiche
- Com'è la vita sul nuovo cacciatorpediniere cinese
- La nuovissima fregata "Ammiraglio della flotta Kasatonov" si sta preparando per i primi test e sta andando in mare Nave ammiraglio Kasatonov
- Sottomarini del tipo Gato
- Insegne sulla flotta mercantile del distaccamento dell'URSS del II gruppo